BIOVIA质量与合规管理(Quality 2 Compliance)通过以数据为中心的全面质量管理新方法来帮助实现质量和业l务卓越性,从而确保数字连续性,数据完整性和信息的单一真相’:集成功能包括具有自动务,电子签名,标准化受控流程和审核跟踪的质量文档内容管理,质量流程管理(例如TCAPA调查或根本原因分析),可通过单个用户界面立即访句问数括文档。质量智能为数据驱动的决策提供趋势和见解。
质量与法规优势
BIOVIA 质量与合规管理(Quality & Compliance)的应用,在为达索客户对确保患者安全、治疗效果、可持续性、保护品牌声誉、等方面起到了至关重要的作用:
- 提高准确性:正确的首次提交内容增加了60%。
- 加快上市:减少批准时间80%。
- 更加合规:法规遵从性提高了85%。
角色/功能
角色一:BIOVIA Qumas
BIOVIA Qumas是一个完全集成的,以数据为中心,基于云的质量管理解决方案,可让您自动化质量流程,促进数据完整性,降低合规风险并实现“质量和合规性卓越”。
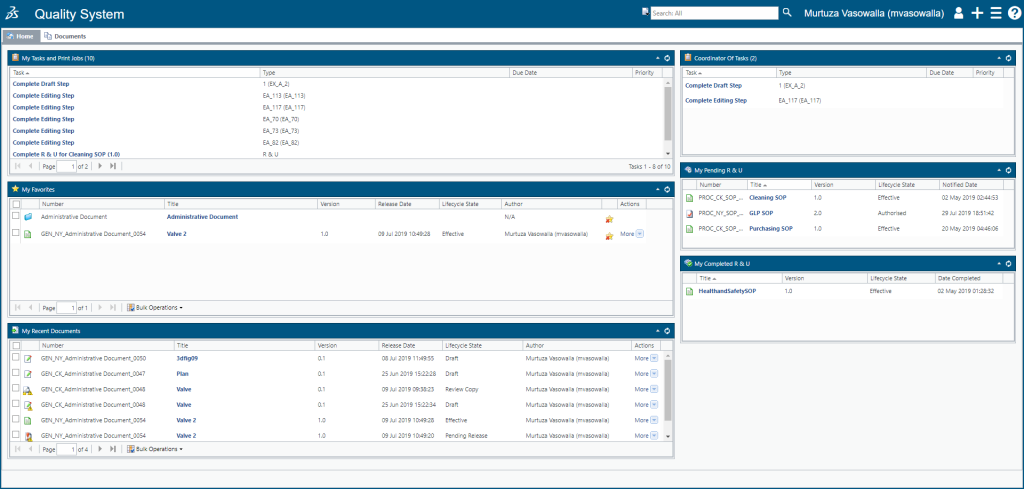
角色二:BIOVIA Qumas EDMS
BIOVIA Qumas Edms(以前称为DocCompliance)使您可以从传统的文档管理过渡到智能的质量内容控制。 QUMAS EDMS 是一个基于云的以数据为中心的电子文档管理软件解决方案,可为整个企业的数据和文档控制,SOP管理以及相关培训提供经过验证的合规性实践。QUMAS EDMS 是符合FDA 21 CFR Part 11的文件管理系统:
- SOP管理成本降低20-40%。
- SOP审查时间减少20-30%。
- 记录时间减少30%。
- 首次提交的权利增加了60%。
Qumas EDMS功能:
一、企业内容管理:
- 控制文档(或文档集)的整个生命周期,从创建到内容编辑,审阅/批准和硬拷贝管理,再到计划的保留和退出。 电子文件管理:编写和管理政策、标准操作程序(SOP)、工作说明和手册-电子通用技术文件(eCTD)、非eCTD和法规提交、CMC(药品和药物)、临床、非临床和质量要求。
- QUMAS EDMS可在全球网络中自动创建,共享,分发和管理SOP,并跟踪SOP生命周期。
二、学习系统管理:
自动执行合规培训和管理过程,或启动,跟踪和管理交互式公司合规培训(由NetDimensions支持)。
- 员工可以完成有关SOP的培训,并认可他们的理解和理解。
- 每位员工都有他们已分配的培训任务的记录,任何未完成的记录以及已完成的培训任务的完整历史记录。
- 管理报告和仪表板可让您清楚地了解个人和部门培训和认证的状态,证据和记录,以向监管机构证明这一点。
三、批量数据管理:
通过企业扫描、文件传输、内容缓存等专用功能有效处理大量文档; 质量保证文档管理:支持质量保证(QA)文档的生命周期管理。 研发提交文件IPA:支持您向全球监管机构提交的材料。配置是特定于R&D的,并遵循DIA EDM参考模型和CTD标准。
- IPA包括专用配置、文档(例如,验证包,设计文档,系统访问计划)、专业服务(安装,最终用户和培训师培训)以及上线后至少3个月的专业服务审核。
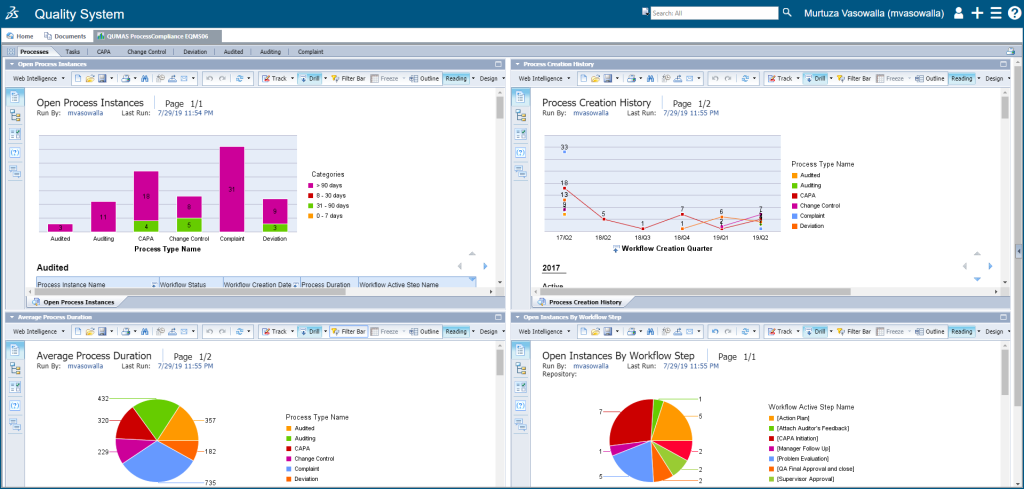
角色三:BIOVIA Qumas EQMS
QUMAS EQMS(以前称为ProcessCompliance)是用于企业质量和流程管理的基于云的解决方案,可在经过验证的QMS环境中提供全面的集成法规,质量和合规性管理功能:
虚拟和物理原型机
- 偏差和CAPA降低10-20%。
- 投诉处理速度提高20-30%。
- 批准时间减少80%。
- 每年节省超过1,575小时的时间。
- 每年节省670万欧元。
Qumas EQMS功能:
Qumas EQMS 通过覆盖广泛的基础功能和针对最常见质量活动的管理功能来支持整个组织的质量控制(QC),这些包括:
一、预先配置的质量流程:
二、仪表板和报告:
三、合规性:
四、协作:
五、访问管理:
您可以在一个名为MyQUMAS的用户友好界面中访问所有质量和合规性功能,从而可以轻松地在合规性内容,流程和任务上进行协作。CAPA管理:借助QUMAS EQMS,您可以创建有效的CAPA过程控制,跟踪并执行因多个工厂之间的偏差而导致的CAPA。从启动到结束,QUMAS捕获,记录,路由并验证完成和批准,所有这些都在审核CAPA流程中的每个步骤。
六、偏差管理:
七、变更控制管理:
借助QUMAS EQMS,您可以简化和有效管理变更控制流程,并评估跨职能部门的产品和流程变更的影响。通过自动化评估,计划,构建,实施,验证和终止项目的变更控制流程,QUIMAS有助于遵守FDA法规(21 CFR第210、820、600部分)和ISO标准(9000、1400等)。有效性审查有助于确保变更控制达到其目标。
八、投诉管理:
九、审计管理:
使用QUMAS EQMS,您可以确保按照审核员期望的时限或法律要求记录,跟踪,更新和解决所有不合格,观察和建议。该系统支持对GCP要求的临床研究进行审核,或对供应商是否符合您的公司质量标准进行审核,或对内部部门进行审核,以准备进行ISo 9001审核。